Ароматические углеводороды: все о них. Ароматичность: критерии ароматичности, правило ароматичности Хюккеля, примеры бензоидных и небензоидных ароматических соединений Строение и химические свойства
АРОМАТИЧНОСТЬ (от греч. aroma, род. падеж aromatos - благовоние), понятие, характеризующее совокупность структурных, энергетич. св-в и особенностей реакц. способности циклич. структур с системой сопряженных связей. Термин введен Ф. А. Кекуле (1865) для описания св-в соединений, структурно близких к - родоначальнику класса .
К числу наиб. важных признаков ароматичности принадлежит склонность ароматич. соед. к замещению, сохраняющему систему сопряженных связей в цикле, а не к присоединению, разрушающему эту систему. Кроме и его производных, такие р-ции характерны для полицикли ч. ароматич. (напр., и их производных), а также для изоэлектронных им сопряженных гетероциклич. соединений. Известно, однако, немало соед. ( , и др.), к-рые также легко вступают в р-ции замещения, но не обладают всеми др. признаками ароматичности.
Реакц. способность не может служить точной характеристикой ароматичности еще и потому, что она отражает св-ва не только осн. состояния данного соединения, но и переходного состояния (активиров. комплекса) р-ции, в к-рую это соед. вступает. Поэтому более строгие критерии ароматичности связаны с анализом физ. св-в осн. электронных состояний циклич. сопряженных структур. Главная трудность состоит в том, что ароматичность не является экспериментально определяемой характеристикой. Поэтому не существует однозначного критерия для установления степени ароматичности, т.е. степени подобия св-вам . Ниже рассмотрены наиб. важные признаки ароматичности.
Строение электронной оболочки ароматических систем.
Тенденция и его производных к сохранению структуры сопряженного кольца в разл. превращениях означает повыш. термодинамич. и кинетич. устойчивость этого структурного фрагмента. Стабилизация (понижение электронной энергии) или , обладающих циклич. структурой, достигается при полном заполнении всех связывающих молекулярных и вакантности несвязывающих и антисвязывающих . Выполнение этих условий достигается, когда общее число в циклич. равно (4л + 2), где п = = 0,1,2... (правило Хюккеля).
Это правило объясняет устойчивость (ф-ла I) и циклопентадиенильного
(II; п = 1). Оно позволило правильно предсказать устойчивость
циклопропенильного (III; п = 0) и циклогептатриенильного (IV; п
= 1) . Ввиду подобияэлектронных
оболочек соед. II-IV и они, как и высшие циклич. - ,
, (V-VII), рассматриваются как ароматич. системы.

Правило Хюккеля можно экстраполировать на ряд сопряженных гетероциклич.
соед. - производные (VIII) и пирилия (IX), изоэлектронные
, пятичленные гетероциклы типа X ( , ), изоэлектронные
циклопентадиенильному . Эти соединения также относят к ароматич.
системам.

Для производных соединений II-Х и др. более сложных структур, получаемых изоэлектронным замещением метиновых групп в I-VII, также характерны высокая термодинамич. устойчивость и общая склонность к р-циям замещения в ядре.
Циклич. сопряженные , имеющие в цикле 4n (n=1,2...), неустойчивы и легко вступают в р-ции присоединения, т. к. обладают незамкнутой электронной оболочкой с частично заполненными несвязывающими . Такие соединения, наиб. типичным примером к-рых служит циклобутадиен (XI), относят кантиароматич. системам.
Правила, учитывающие число в цикле, полезны для характеристики св-в моноциклич. структур, однако неприложимы к полициклам. При оценке ароматичности последних необходимо учитывать, как соответствуют этим правилам электронные оболочки каждого отдельного цикла . С осторожностью следует пользоваться ими и в случае многозаряженных циклич. . Так, электронные оболочки дикатиона и дианиона циклобутадиена отвечают требованиям правила Хюккеля. Однако эти структуры нельзя относить к ароматическим, т. к. дикатион (п = 0) устойчив не в плоской форме, обеспечивающей циклич. сопряжение, а в согнутой по диагонали; дианион (n=1) вообще неустойчив.
Энергетические критерии ароматичности. Энергия резонанса. Для определения количеств. меры ароматичности, характеризующей повыш. термодинамич. устойчивость ароматич. соед., было сформулировано понятие энергии резонанса (ЭР), или энергии делокализации.
Теплота , формально содержащей три , на 151 кДж/ больше, чем теплота трех . Эту величину, связываемую с ЭР, можно рассматривать как энергию, дополнительно затрачиваемую на разрушение циклич. системы сопряженных бензольного кольца, стабилизирующей эту структуру. Т. обр., ЭР характеризует вклад циклич. сопряжения в (полную энергию, теплоту атомизации) соединения.
Предложен ряд способов теоретич. оценок ЭР. Они различаются гл. обр.
выбором структуры сравнения (т.е. структуры, в к-рой нарушено циклич. сопряжение)
с циклич. формой. Обычный подход к вычислению ЭР состоит в сопоставленииэлектронных
энергийциклич.
структуры и суммы энергий всех изолированных , содержащихся
в ней. Однако рассчитываемые т. обр. ЭР, независимо от используемого квантовохим.
метода, имеют тенденцию к возрастанию с увеличением размеровсистемы.
Это нередко противоречит эксперим. данным о св-вах ароматич. системы. Так,
ароматичность в ряду полиаценовбензол (I), (XII), (XIII), тетрацен
(XIV) понижается (напр., возрастает склонность к присоединению, увеличивается
альтернирование длин связей), а ЭР (приведены в единицах=
75 кДж/) растут:

Этого недостатка лишены величины ЭР, рассчитываемые путем сравненияэлектронных энергий циклич. структуры и аналогичного ациклич. сопряженного полнена (М. Дьюар, 1969). Рассчитанные т. обр. величины принято называть ЭР Дьюара (ЭРД). Напр., ЭРД (1,013) вычисляется при сопоставлении его с 1,3,5-гексатриена, а ЭРД циклобутадиена-сопоставлением его= = с 1,3-бутадиена.
Соединения с положит. значениями ЭРД относят к ароматическим, с отрицательными-к
антиароматическим, а со значениями ЭРД, близкими к нулю, - к неароматическим.
Хотя значения ЭРД варьируют в зависимости от приближений квантовохим. метода
расчета, относит. порядок их практически не зависит от выбора метода. Ниже
приведены ЭРД в расчете на один
(ЭРД/е; в единицах),
вычисленные по модифициров. Хюккеля:

Наиб. ЭРД/е, то есть наиб. ароматичностью, обладает . Понижение ЭРД/е отражает понижение ароматич. св-в. Приведенные данные хорошо согласуются со сложившимися представлениями о проявлениях ароматичности.
Магнитные критерии ароматичности. Циклич. сопряжение приводит к возникновению в кольцевого тока, к-рый вызывает экзальтацию диамагн. восприимчивости. Поскольку величины кольцевого тока и экзальтации отражают эффективность циклич. сопряжения, они м. б. использованы как количеств. мера ароматичности.
К ароматическим относятся соед., в к-рых поддерживаются наведенные диамагнитныеэлектронные кольцевые токи (диатропные системы). В случае аннуленов (n = 0,1,2...) существует прямая пропорциональность между силой кольцевого тока и величиной ЭРД. Однако для неальтернантных (напр., ) и гетероциклич. соед. эта зависимость усложняется. В ряде случаев система м.б. одновременно и диатропной и антиароматической, напр. бициклодекапентаен.
Наличие индуциров. кольцевого тока в циклич. сопряженных системах характерно проявляется в спектрах протонного магн. резонанса (ПМР), т.к. ток создает анизотропное магн. поле, заметно влияющее на хим. сдвиги , связанных с кольца. Сигналы , расположенных во внутр. части ароматич. кольца, смещаются в сторону сильного поля, а сигналы , расположенных на периферии кольца, - в сторону слабого поля. Так, внутр. (ф-ла VI) и (VII) проявляются при - 60°С в спектре ПМР соотв. при 0,0 и -2,99м. д., а внешние-при 7,6 и 9,28 м. д.
Для антиароматич. систем аннуленов, наоборот, характерны парамагн. кольцевые токи, приводящие к сдвигу внеш. в сильное поле (паратропные системы). Так, хим. сдвиг внеш. равен всего 4,8 м.д.
Структурные критерии ароматичности. Важнейшие структурные характеристики - ее планарность и полная выравненность связей. можно рассматривать как ароматическую, если длины углерод-углеродных связей в ней лежат в пределах 0,136-0,143 нм, т.е. близко к 0,1397 нм для (I). Для нециклич. сопряженных полиеновых структур длины связей С-С составляют 0,144-0,148 нм, а связей С=С-0,134-0,135 нм. Еще большее альтернирование длин связей характерно для антиароматич. структур. Это подтверждается данными строгих неэмпирич. расчетов геометрич. параметров циклобутадиена и эксперим. данными для его производных.
Предложены разл. выражения для количеств. характеристики ароматичности по степени
альтернирования длин связей, напр. для вводится индекс ароматичности
(НОМА d):
где а = 98,89, Х r - длина r-ной связи (в А), n-число связей. Для
Ароматические углеводороды - это циклические, сопряженные соединения, которые благодаря своему строению проявляют особые физико-химические свойства. Позже к понятию "ароматические углеводороды" было отнесено их специфические физико-химические свойства:
- Склонность преимущественно к реакциям замещения;
- Устойчивость к воздействию окислителей и высоких температур.
Простейшим представителем аренов является бензол и его гомологи, конденсированные бензоидные, небензоидные и гетероциклические соединения.
Ароматичность представляется особой стабилизацией делокализованных циклических $\pi$-систем, содержащих ($4n + 2$) $\pi$-электронов. Этой «особой стабилизации» не наблюдается в случае ($4n$) $\pi$ циклических систем. Для малых циклов такая система будет дестабилизированной, т.е. такие системы будут «антиароматическими». Однако утверждение об особой стабилизации требует не только теоретических выкладок, но и определенных экспериментальных подтверждений. В связи с этим вопрос о выборе надежных экспериментальных критериев ароматичности приобретает принципиальную важность.
Признаки ароматичности
Ароматический характер углеводородов обусловлен как легкостью образования ароматических циклов, так и особенностью их физических и химических свойств.
Характерные свойства ароматических соединений (аренов) определяются своеобразностью их строения и обусловливают химический критерий ароматичности:
Физико-химические критерии ароматичности
Основным критерием ароматичности является соответствии молекулы основным требованиям:
- Молекула должна быть циклической и плоской;
- Молекула должна иметь замкнутую цепь сопряжения $\pi$-электронов;
- Количество $\pi$-электронов ($N$) в цепи сопряжение должно соответствовать правилу Хюккеля: $N = 4n + 2$, где $n = 0,1,2,3$ ...
Поэтому энергия сопряжение является главным критерием ароматичности.
Если соединение соответствует всем критериям ароматичности, то энергия сопряжение в молекулах достигает максимального значения, а сама соединение в результате этого становится чрезвычайно стабильной. Поэтому энергия сопряжение является главным критерием ароматичности.
Согласно определению IUРАС, ароматичность можно охарактеризовать как «понятие пространственной и электронной структуры циклических молекулярных систем, отражает эффекты циклической делокализации электронов, которые обеспечивают повышенную термодинамическую стабильность этих систем (по сравнению с ациклическими структурными аналогами) и тенденцию к сохранению структурного типа в ходе химических преобразований... ». Говоря о стабилизации циклических структур по сравнению с «ациклическими аналогами» ароматичность появляется как энергетически топологическое понятие, которое можно примерно оценить по физико-химическим наблюдениями. «Ациклические аналоги» на самом деле могут быть даже несуществующими химическими соединениями, а «плодом воображения с топологическими пределами».
Критерии оценки ароматичности
Критерии оценки ароматичности могут быть разделены на две категории в зависимости от контекста наблюдения - статические (изолированные молекулы) и динамические (молекула подвергается воздействию внешнего магнитного поля). Энергетические критерии (энтальпия реакций) и структурные (изменение длин связей) обуславливают принципиально различные магнитные критерии (ЯМР, изменения магнитной чувствительности) (Таблица 1).
Рисунок 4. Классификация критериев ароматичности
Структурная и энергетическая ароматичность
«Структурную» ароматичность можно оценить по средним длинами связей и отклонениями от этого среднего значения.
«Энергетическая» ароматичность может быть оценена через энтальпии реакций с раскрытием цикла. Резонансные энергии ($RE$), такие как резонансная энергия Бреслоу ($BRE$), рассчитываются по методу Хюккеля, в то время как для расчета энергий ароматической стабилизации ($ASE$) используют неэмпирические методы (ah initio).
Магнитная ароматичность
«Магнитная» ароматичность, обычно определяется количественно с помощью ЯМР, дезекрануванням ядер и независимого химического сдвига центра цикла (NICS «Nucleus Independent Chemical Schift»), как было предложено Шлейером в 1996г.
Выше ароматические соединения были определены как соединения» напоминающие бензол. Но какими именно свойствами бензола должно обладать соединение для того, чтобы его можно было отнести к числу ароматических? Помимо соединений, содержащих бензольные кольца, имеется еще множество других веществ, которые называют ароматическими, хотя некоторые из них внешне мало похожи на бензол.
Какие же свойства характерны для всех ароматических соединений?
С эмпирической точки зрения ароматическими соединениями являются соединения, молекулярная формула которых соответствует высокой степени ненасыщенности и которые тем не менее не вступают в реакции присоединения, характерные обычно для ненасыщенных соединений. Вместо реакций присоединения эти ароматические соединения часто наподобие бензола вступают в реакции электрофильного замещения. Наряду с инертностью в реакциях присоединения проявляется также необычная стабильность этих соединений - низкие значения теплот гидрирования и сгорания. Ароматические соединения имеют циклическую структуру - обычно содержат пяти-, шести- или семичленные циклы - и при их изучении физическими методами обнаруживается, что их молекулы плоские (или почти плоские). Протоны в этих соединениях имеют примерно такие же величины химических сдвигов в ЯМР-спектрах (разд. 13.18), как протоны в бензоле и его производных.
С теоретической точки зрения для того, чтобы соединение было ароматическим, в его молекуле должна содержаться циклическая система делокализованных -электронов выше и ниже плоскости молекулы; более того, облако -электронов должно насчитывать -электронов. Иначе говоря, для той степени устойчивости, которая характерна для ароматических соединений, одной делокализации недостаточно. В молекуле должно содержаться строго определенное число -электронов- 2, или 6, или 10 и т. д. Это требование, известное под названием правила или правила Хюккеля (по имени Эриха Хюккеля, Институт теоретической физики, Штуттгарт), основано на квантовой механике и связано с требованиями заполнения различных орбиталей, образующих -облако. Справедливость правила Хюккеля хорошо подтверждается фактами.
Рассмотрим некоторые данные, подтверждающие правило Хюккеля. В бензоле имеется шесть -электронов, ароматический секстет; число шесть является числом Хюккеля для Помимо бензола и подобных ему веществ (нафталин, антрацен, фенантрен, гл. 35), мы встретимся еще с большим числом гетероциклических соединений которые обладают четко выраженными ароматическими свойствами; как будет показано, к подобным
ароматическим гетеродиклам относятся те соединения, в которых может возникнуть ароматический секстет.
В качестве других примеров рассмотрим следующие шесть соединений, для каждого из которых приведена лишь одна резонансная структура:

Каждая молекула представляет собой гибрид пяти или шести эквивалентных структур, содержащих заряд или неспаренный электрон на каждом из атомов углерода. Тем не менее из этих шести соединений лишь два обладают необычно высокой стабильностью: циклопентадиенил-анион и цикло-гептатриенил-катион (тропилий-ион).
Циклопентадиен - необычайно сильная кислота для углеводорода что указывает на повышенную устойчивость аниона, образующегося при отрыве иона водорода. (Циклопентадиен - гораздо более сильная кислота, чем циклогептатриен, хотя анион последнего стабилизован за счет резонанса семи структур.) Дициклопентадиенилжелезо (ферроцен) представляет собой стабильную молекулу, имеющую структуру сэндвича, в котором атом железа находится между двумя ллоскими пятичленными циклами. Все связи углерод - углерод имеют длину 1,4 А . Кольца ферроцена вступают в типичные реакции ароматического замещения - сульфирование и реакцию Фриделя - Крафтса.

Среди циклогептатриенилпроизводных именно катион обладает необычными свойствами. Бромистый тропилий плавится выше растворим в воде, но нерастворим в неполярных растворителях и мгновенно осаждает при действии Подобное поведение необычно для органического бромида и заставляет предполагать, что даже в твердом состоянии имеют дело с ионным соединением в котором катион действительно является стабильным карбониевым ионом.
Рассмотрим электронную конфигурацию циклопентадиенил-аниона (рис. 10.5). Каждый атом углерода тригонально гибридизован и связан -связями с двумя другими атомами углерода и одним атомом водорода. Кольцо циклопентадиенил-аниона представляет собой правильный пятиугольник, углы которого ; некоторая неустойчивость, возникающая из-за несовершенного перекрывания (угловое напряжение), более чем компенсируется за счет возникающей делокализации. Четыре атома углерода имеют по одному электрону на каждой -орбитали, пятый атом углерода (тот, который потерял протон, но в действительности, конечно, неотличимый от других) - пару электронов.

Рис. 10.5. Циклопентадиенил-анион. а - два электрона а -орбитали одного из атомов углерода, по одному электрону на -орбиталях у каждого из остальных атомов углерода; б - перекрывание -орбиталей с образованием -связей; в - -облака выше или ниже плоскости кольца; имеется всего шесть -электронов, т. е. ароматический секстет.
Перекрывание -орбиталей приводит к образованию -облаков, содержащих в сумме шесть электронов, т. е. ароматический секстет.
Аналогичным образом изображается конфигурация тропилий-иона. Он представляет собой правильный семиугольник {углы равны 128,5° (2,242 рад)]. Шесть атомов углерода имеют по одному -электрону, а седьмой - только пустую -орбиталь. В результате возникает ароматический секстет.
Рассмотренные ионы удобнее всего изображать следующим образом:

Чаще всего встречаются системы с числом Хюккеля, равным шести, что вполне понятно. Для того чтобы атомы ароматического кольца имели -орбитали, необходимо, чтобы они находились в -гибридизации и, следовательно, в идеале углы связей должны равняться того чтобы стало возможным перекрывание -орбиталей, приводящее к образованию -облака, ароматическое соединение должно быть плоским или почти плоским. Число тригонально гибридизованных атомов, которые могут образовать плоское кольцо без слишком сильного углового напряжения, равно пяти, шести или семи, а лишь плоское кольцо допускает достаточное перекрывание для образования -связи. Число Хюккеля, равное шести, соответствует числу -электронов, которые могут быть предоставлены в общую систему указанным числом атомов кольца. (Совсем не случайно, что бензол, служащий примером ароматического соединения, является также идеальной структурой: он содержит шесть атомов, способных отдать шесть -электронов и образующих шестиугольник, углы которого в точности соответствуют тригональным.)
Рассмотрим теперь, какие имеются данные в пользу того, что другие числа Хюккеля также являются «магическими числами»? В этих случаях нельзя ожидать, что ароматический характер будет обязательно проявляться в чрезвычайной устойчивости соединений, сравнимой с устойчивостью бензола и родственных соединений. Циклы с указанным числом атомов углерода будут слишком малы или слишком велики для того, чтобы в них могли хорошо разместиться тригонально гибридизованные атомы углерода. Поэтому любая стабилизация за счет ароматичности в значительной степени может быть скомпенсирована угловым напряжением или. малой степенью перекрывания -орбиталей или обоими факторами.
Устойчивость следует рассматривать только в плане сравнительном, как это было сделано выше для циклопентадиенил- и циклогептатриенил-производных, и доказательство наличия ароматичности следует видеть уже в том факте, что та или иная молекула оказывается стабильнее, чем родственные. Правило было полностью подтверждено экспериментально. В настоящее время задачей исследований является выяснение более сложного вопроса, а именно: при какой максимально неблагоприятной комбинации углового напряжения и электростатических отталкиваний из-за наличия нескольких зарядов все еще можно наблюдать проявление ароматичности?
(см. скан)
А РЕНЫ
Ароматические углеводороды (арены) – циклические углеводороды, объединяемые понятием ароматичности, которая обуславливает общие признаки в строении и химических свойствах.
Классификация
По числу бензольных колец в молекуле арены подразделяются на:
моноядерные
многоядерные

Номенклатура и изомерия
Структурным родоначальником углеводородов бензольного ряда служит бензол С 6 Н 6 от которого строятся систематические названия гомологов.
Для моноциклических соединений сохраняются следующие несистематические (тривиальные) названия:

Положение заместителей указывают наименьшими цифрами (направление нумерации не имеет значения),
|
|
|
а для ди замещенных соединений можно использовать обозначения орто, мета , пара.
|
|
|
|
Если в кольце три заместителя тони должны получить наименьшие номера, т.е. ряд «1,2,4» имеет преимущество перед «1,3,4».


1,2-диметил-4-этилбензол (верное название) 3,4-диметил-1-этилбензол (неверно)
Изомерия монозамещенных аренов обусловлена строением углеродного скелета заместителя, у ди- и полизамещенных гомологов бензола добавляется ещё изомерия, вызванная различным расположением заместителей в ядре.
Изомерия ароматических УВ состава С 9 Н 12:
|
|
|
|
|
Физические свойства
Температуры кипения и плавления у аренов выше, чем у алканов, алкенов, алкинов, малополярные, не растворимы в воде и хорошо растворимы в неполярных органических растворителях. Арены это жидкости или твердые вещества, имеющие специфические запахи. Бензолы и многие конденсированные арены токсичны, некоторые из них проявляют концерогенные свойства. Промежуточными продуктами окисления конденсированных аренов в организме являются эпоксиды, которые либо сами непосредственно вызывают рак, либо являются предшественниками канцерогенов.
Получение аренов
Многие ароматические УВ имеют важное практическое значение и производятся в крупном промышленном масштабе. Ряд промышленных способов основан на переработке угля и нефти.
Нефть состоит главным образом из алифатических и алициклических УВ, для превращения алифатических или ациклических УВ в ароматические разработаны способы ароматизации нефти, химические основы которых развиты Н.Д. Зелинским, Б.А. Казанским.
1. Циклизация и дегидрирование:
2. Гидродезметилирование:

3. Гомологи бензола получают путем алкилирования или ацилирования с последующим восстановлением карбонильной группы.
а) Алкилирование по Фриделю-Крафтсу:

б) Ацилирование по Фриделю-Крафтсу:

4. Получение бифенила по реакции Вюрца-Фитинга:
5. Получение дифенилметана по реакции Фриделя-Крафтса:
Строение и химические свойства.
Критерии ароматичности:
На основании теоретических расчетов и экспериментального изучения циклических сопряженных систем было установлено, что соединение ароматично, если оно имеет:
- Плоский циклический σ-скелет;
- Сопряженную замкнутую π-электронную систему, охватывающую все атомы цикла и содержащую 4n + 2, где n = 0, 1, 2, 3 и т.д. Эта формулировка известна, как правило Хюккеля. Критерии ароматичности позволяют отличать сопряженные ароматические системы от всех других. Бензол содержит секстет π-электронов и соответствует правилу Хюккеля при n = 1.
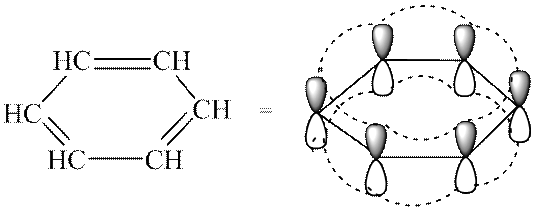
Что дает ароматичность:
Несмотря на высокую степень ненасыщенности, ароматические соединения устойчивы к действию окислителей и температуры, они более склонны вступать в реакции замещения, а не присоединения. Эти соединения обладают повышенной термодинамической стабильностью, обеспечивающейся высокой энергией сопряжения ароматической системы кольца (150 кДж/моль), поэтому арены предпочтительней вступают в реакции замещения, в результате чего сохраняют ароматичность.
Механизм реакций электрофильного замещения в ароматическом кольце:
Электронная плотность π-сопряженной системы бензольного кольца является удобным объектом для атаки электрофильными реагентами.
Как правило, электрофильные реагенты генерируются в процессе реакции при помощи катализаторов и соответствующих условий.
Е – Y → E δ + – Y δ - → E + + Y -
Образование π-комплекса. Первоначальная атака электрофилом π-электронного облака кольца приводит к координации реагента с π-системой и образованию комплекса донорно-акцепторного типа называемого π-комплекса. Ароматическая система не нарушается:

Образование σ-комплекса. Лимитирующая стадия, на ней электрофил образует ковалентную связь с атомом углерода за счет двух электронов π-системы кольца, что сопровождается переходом данного атома углерода из sp 2 - в sp 3 - гибридное состояние и нарушением ароматической, молекула превращается в карбокатион.

Стабилизация σ-комплекса. Осуществляется путем отщепления от σ-комплекса протона с помощью основания. При этом за счет двух электронов разрывающейся ковалентной связи С – Н восстанавливается замкнутая π-системы кольца, т.е. происходит возврат молекулы в ароматическое состояние:

Влияние заместителей на реакционную способность и ориентацию электрофильного замещения
Заместители в бензольном кольце нарушают равномерность в распределении π- электронного облака кольца и тем самым оказывают влияние на реакционную способность кольца.
- Электронодонорные заместители (Д) повышают электронную плотность кольца и увеличивают скорость электрофильного замещения, такие заместители называют активирующими.
- Электроноакцепторные заместители (А) понижают электронную плотность кольца и уменьшают скорость реакции, называются дезактивирующими.
Арены (ароматические углеводороды) - соединения, в молекулах которых содержится одно или несколько бензольных колей - циклических групп атомов углерода со специфическим характером связей.
Бензол - молекулярная формула С 6 Н 6 . Впервые была предложена А. Кекуле:
Строение аренов.
Все 6 атомов углерода находятся в sp 2 -гибридизации . Каждый атом углерода образует 2 σ -связи с двумя соседними атомами углерода и одним атомом водорода, которые находятся в одной плоскости. Углы составляют 120°. Т.е. все атомы углерода лежат в одной плоскости и образуют шестигранник. У каждого атома есть негибридная р -обиталь, на которой находится неспаренный электрон. Эта орбиталь перпендикулярна плоскости, и поэтому π -электронное облако «размазано» по всем атомам углерода:

Все связи равноценны. Энергия сопряжения - количество энергии, которую надо затратить, чтобы разрушить ароматическую систему.
Именно это обуславливает специфические свойства бензола - проявление ароматичности. Это явление было открыто Хюккелем, и называется правилом Хюккеля.
Изомерия аренов.
Арены можно разделить на 2 группы:
- производные бензола:

- конденсированные арены:

Общая формула аренов - С n H 2 n -6 .
Для аренов характерна структурная изомерия, которая объясняется взаимным расположением заместителей в кольце. Если в кольце находится 2 заместителя, то они могут находиться в 3-х различных положениях - орто (о-), мета (м-), пара (п-):

Если от бензола «отобрать» один протон, то образуется радикал - C 6 H 5 , которое носит название арильного радикала. Простейшие:

Называют арены словом «бензол» с указанием заместителей в кольце и их положения:

Физические свойства аренов.
Первые члены ряда - жидкости без цвета с характерным запахом. Они хорошо растворяются в органических растворителях, но нерастворимы в воде. Бензол токсичен, но имеет приятный запах. Вызывает головную боль и головокружения, при вдыхании больших количеств паров можно потерять сознание. Раздражает слизистую оболочку и глаза.
Получение аренов.
1. Из алифатических углеводородов с помощью «ароматизации» предельных углеводородов, входящих в состав нефти. При пропускании над платиной или оксидом хрома наблюдается дигидроциклизация:

2. Дегидрирование циклоалканов:

3. Из ацетилена (тримеризация) при пропускании над раскаленным углем при 600°С:

4. Реакция Фриделя - Крафтса в присутствии хлорида алюминия :

5. Сплавление солей ароматических кислот с щелочью:
Химические свойства аренов.
Реакции замещения аренов.
Ядро аренов обладает подвижной π -системой, на которую действуют электрофильные реагенты. Для аренов характерно электрофильное замещение, которое можно представить так:

Электрофильная частица притягивается к π -системе кольца, затем образуется прочная связь между реагентом Х и одним из атомов углерода, при этом единство кольца нарушается. Для восстановления ароматичности выбрасывается протон, а 2 электрона С-Н переходят в π-систему кольца.
1. Галогенирование происходит в присутствии катализаторов - безводных хлоридов и бромидов алюминия , железа :

2. Нитрование аренов. Бензол очень медленно реагирует с концентрированной азотной кислотой при сильном нагревании. Но если добавить серную кислоту , то реакция протекает очень легко:
3. Сульфирование протекает под воздействием 100% - серной кислоты - олеума:
4. Алкилирование алкенами . В результате происходит удлинение цепи, реакция протекает в присутствии катализатора - хлорида алюминия:
Реакции присоединения аренов.
1. Гидрирование (при катализаторах) аренов:

2. Радикальное галогенирование при взаимодействии паров бензола и сильного УФ-излучения. В результате образуется твердый продукт - С 6 H 6 Cl 6 :

3. Окисление кислородом воздуха. Реакция протекает при оксиде ванадия (V) и 400°С:

Гомологи бензола имеют ряд отличий - на их продукты я изначальный заместитель в кольце:
Замещение в кольце возможно только в присутствие катализатора (хлорида железа и алюминия), замещение протекает в орто- и пара- положения по отношению к алкильному радикалу:

Если действуют сильные окислители (перманганат калия), то цепь алкильная разрушается и образуется бензойная кислота:


Дополнительные материалы по теме: Арены. Свойства аренов.
Химия 7,8,9,10,11 класс, ЕГЭ, ГИА |
|
| Основная информация по курсу химии для обучения и подготовки в экзаменам, ГВЭ, ЕГЭ, ОГЭ, ГИА | |













